【明報專訊】肝癌是香港第3號癌症殺手,2017年共奪去1552人性命。
美國食品及藥物管理局(FDA)把標靶治療列為晚期肝癌病人一線治療,最新研究指免疫治療PD-1抑制劑是有效的肝癌第二線治療。現時有不同的臨牀研究,把免疫療法與標靶藥物或立體定位放射治療(SBRT)一同使用,希望加強治療效果。
(magicmine@iStockphoto)
第二線治療——最新研究指免疫治療PD-1抑制劑,是肝癌第二線治療,有效率約為15至20%,比傳統二線標靶藥的10%理想。
癌魔入侵肝門靜脈 不宜動手術
陳先生,65歲,剛確診肝癌,腫瘤達16公分並入侵肝門靜脈,肝功能已轉差,Child-Pugh分級為B。Child-Pugh分級是肝硬化嚴重度分級,分A、B、C等3個級別,C為最嚴重。外科醫生評估後認為不適宜手術切除,轉介臨牀腫瘤科。病人首次來見我時臉色已泛黃,但精神尚可。他兒子問道:我們在網上讀了不少關於免疫治療的資料,未知我爸爸能否採用?
擴散肺部 曾用標靶治療
李先生,60歲,乙型肝炎患者,4年前患上肝癌,曾接受多次手術及射頻消融的治療,病情受控,奈何今年起情况反覆轉差,肝臟及肺部有多處擴散,曾採用標靶治療,但後因嚴重的手足綜合症而停藥。首次求診時他和太太擔心問道:我的女兒約半年後結婚,我很想親身參與,但實在憂慮屆時我的身體狀况,醫生,你能否幫我完成心願。
人體的免疫系統,能抵禦外來細菌及病毒入侵,保護身體免受傷害。理論上免疫系統亦能消滅不正常細胞,如癌細胞等。但癌細胞非常狡猾,能激活體內煞車系統,阻礙免疫細胞辨認能力,癌細胞躲過追捕並增生,破壞身體機能。直至近年,2018年奪得諾貝爾醫學獎的美日學者,發現免疫細胞上的蛋白「PD-1」及「CTLA-4」為免疫系統煞車的元兇,研發出相應抑制劑,使免疫細胞重新辨識並消滅癌細胞。
狡猾癌細胞 「扮嘢」避追捕
癌細胞表面的PD-L1配體,當與免疫細胞的PD-1結合時,便會抑制了免疫細胞的殺癌功能,情况恍如癌細胞喬裝成正常細胞,避過免疫細胞的監察。而免疫檢查點(PD-1)抑制劑的作用便是阻止癌細胞的PD-L1配體與免疫細胞的PD-1接觸,重新激活免疫系統的抗癌機能。
臨牀研究已證實免疫檢查抑制劑可用於治療黑色素瘤、肺癌、腎癌、膀胱癌、頭頸癌等癌症,而最新研究亦發現免疫療法能應用於肝癌病人。
(作者提供)
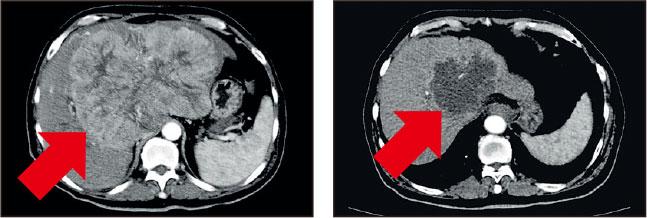
腫瘤壞死——治療前(左)及治療後(右),掃描影像顯示治療腫瘤完全壞死。
根治措施只適合早期肝癌
肝癌是現時香港第3號癌症殺手,早期患者可透過外科手術、肝臟移植,或射頻消融達根治效果。但只有30%的患者確診時適合上述根治性措施,其餘70%患者確診時已到中期或晚期,傳統上只能採取標靶藥治療或經動脈化療栓塞(trans-arterial chemoembolization, TACE)。經動脈化療栓塞是在病人腹股溝動脈插入導管至肝動脈,直接注入化療藥物及栓塞物至肝腫瘤,殺死癌細胞。
現時晚期肝癌病人的一線治療為標靶藥物:索拉非尼(Sorafenib) 或樂伐替尼(Lenvatinib)。研究顯示標靶治療能提高病人存活率,但治療有一定局限,首先是治療本身的副作用,其次是藥物只適用於肝功能理想的病人(Child-Pugh分級A) ,而且用藥平均3至6個月後,大部分患者都會產生抗藥性,需轉用其他治療。
最新研究指PD-1抑制劑是有效的肝癌第二線治療,其好處及特點如下:
- 有效率約為15至20%,比傳統二線標靶藥10%理想
- 腫瘤控制較持久,對免疫治療有效的病人,90%治療反應會持續超過半年,愈50%的病人效果更會持續超過1年
- 副作用相對較少,較常見的副作用有:疲倦、皮疹、痕癢、肚瀉、肺炎、肝炎等;較嚴重的反應率約20%,較標靶藥的50%為低
- 最新資料顯示,免疫治療亦可用於肝功能已開始轉差(Child-Pugh分級B)的病人
但免疫療法並非適用於所有癌症患者,例如肝功能已屆末期 (Child-Pugh分級C)或自身有免疫系統疾病的患者。而免疫療法亦非全無副作用,嚴重反應的患者需服類固醇作為解藥。
雙管齊下 腫瘤完全壞死
陳先生在接受半年的免疫治療及立體定位放射治療後,腫瘤完全壞死,其間在停藥1年後完全沒有復發迹象。而李先生接受PD-1抑制劑後,病情受控,亦能如願健康地出席女兒的大喜日子。當他們分享和家人難忘時刻的相片時,即使我未有置身其中,隔着個「芒」亦能感受到他們的喜悅和感恩之情。
文:蔣子樑(香港大學臨牀腫瘤科臨牀助理教授)
編輯:王翠麗